
SiO₂ とは?
石や鉱物に関する書籍を見ると、
「SiO₂」(エスアイオーツー)という成分をよく目にします。
これは「二酸化ケイ素」という物質の化学式です。
二酸化ケイ素(SiO₂)とは、「Si」(ケイ素)と「O」(酸素)から成る化合物のことです。


ケイ素の元素記号 Si は、
英語の「Silicon」シリコン(ケイ素)に由来します。

「SiO₂ = ケイ素の酸化物」です。

SiO₂ は「シリカ」とも呼ばれ、日常では乾燥剤(シリカゲル)の主原料として用いられています。
鉱物の成分として見た場合、
この二酸化ケイ素(SiO₂)をその成分に持つ鉱物は数多く存在します。
また、直接は含まれていなくても、SiO₂ を基盤とする成分を持った鉱物を合わせると、
地球の地殻の約90%以上を占めるともいわれています。
これらの鉱物は、総称して「ケイ酸塩鉱物(けいさんえんこうぶつ)」と呼ばれます。

長石、石英、輝石、角閃石、雲母などなど。
※鉱物学では「石英」をケイ酸塩鉱物に含めます。

鉱物の構成要素として非常に重要な成分であるといえます。
石英(水晶)とは?
「石英」は、SiO₂ が結晶してできた鉱物の代表ともいえる存在です。

『結晶』とは、原子、分子が ”規則正しく並んで” できたものです。
石英の結晶は、
SiO₂ が主成分(ほぼ100%)で構成されているため純粋なシリカから成る鉱物といえます。

微量の不純物はあるとしても、
成分という意味では SiO₂ だけが構成要素となります。
【石英 (水晶)】
組成:SiO₂
結晶系:三方晶系または六方晶系
鉱物の説明としては、このように表記される場合が多いです。⬆︎
『鉱物がどのような成分や要素から構成されているか』は化学式で表し、
「組成(そせい)」や「組成式」という呼び方をします。
また、ここにある ”結晶系” とは、結晶の並び方で「結晶構造」の分類法のひとつです。

『結晶系』は、全部で7種類あります。
- 立方(りっぽう)晶系
または 等軸(とうじく)晶系 - 正方(せいほう)晶系
- 六方(ろっぽう)晶系
- 三方(さんぼう)晶系
- 単斜(たんしゃ)晶系
- 斜方(しゃほう)晶系
- 三斜(さんしゃ)晶系

それぞれの違いについては、今回は触れませんので、
名称だけ紹介します。

…でも、なんで結晶系を示すの?
通常、鉱物は、成分(組成)だけでは特定できません。
なぜなら、同じ成分でも違う鉱物が存在するためです。
その違いは、結晶の並び方によって生じます。
なので、一般的には ”結晶系” と組み合わせることで、鉱物を特定することができるのです。
鉱物 = 組成式 + 結晶系
ゆえに、
石英 = SiO₂ + 三方晶系(六方晶系)
となるわけです。
石英の結晶系
石英には、「低温型石英」と「高温型石英」があります。
その違いは、形成される温度 と 結晶系の違いです。
低温型の石英(α-石英):
- 自然界で最も一般的に見られる石英の形態です。
- この形態は、温度が約573℃以下で安定しています。
- 三方晶系に属します。
高温型の石英(β-石英):
- 高温の環境で見られる形態です。
- この形態は、温度が約573℃以上で安定します。
- 六方晶系に属します。
約573℃を境に高温型と低温型に分かれますが、
温度変化に応じて、これら二つの形態を行き来する可逆性を持ちます。

つまり、最初にどちらかで形成されても環境温度が変われば、
それに合わせて形態が変化します。
その際の変化というのは、結晶構造の変化で、
三方晶系と六方晶系の間で原子配列の再配置が起こります。
これを「相転移(そうてんい)」といいます。

固体状態のまま生じる内部変化なので、
いちど溶解する「再結晶」とは違います。

高温型石英は、稀な存在ですが、
結晶系が異なる石英があると理解してもらえれば良いです。
SiO₂ と結晶系
SiO₂ が組成である結晶は、自然界では圧倒的に石英が多いため、
「SiO₂ の結晶 = 石英」という認識が一般的です。
しかし、実際には石英以外の鉱物も存在します。
ただそれらは、かなり特殊な環境下で形成されるため希少鉱物の部類に入ります。
SiO₂ の結晶
- 石英
- α-石英(三方晶系)
- β-石英(六方晶系)
- トリディマイト
- α-トリディマイト(斜方晶系)
- β-トリディマイト(六方晶系)
- クリストバライト
- α-クリストバライト(正方晶系)
- β-クリストバライト(立方晶系)
- コーサイト(単斜晶系)
- スティショバイト(正方晶系)

もともと希少であることと研究対象としての扱いが多いため、
これらは市場にはほとんど出まわっていません。

リビアングラスに含有する形でクリストバライトを見かけるくらいです。
SiO₂ の結晶は、7種類ある結晶系のうち、三斜晶系を除く6種類で存在しています。
また、β-石英とβ-トリディマイト(六方晶系)や
α-クリストバライトとスティショバイト(正方晶系)のように
同じ結晶系のものが存在します。
これは、前述した 『”組成” と ”結晶系” で鉱物を特定する』
に当てはまらない『例外』です。

かなり稀なケースですが、
この場合は、さらに詳細な結晶構造の違いで区別する必要があります。
SiO₂ のように、
『同じ組成(成分)』 の物質が、『異なる結晶構造(結晶系)』 で存在することを、
「多形(たけい)」または「同質異像(どうしついぞう)」といいます。

多形は他にも、ダイヤモンドとグラファイト(C)、
カルサイトとアラゴナイト(CaCO₃)などがあります。
低温型石英と高温型石英のところで、”相転移” について触れましたが、
「相」とは、「物質の三態」(気体、液体、固体)のより広い概念です。

固体は、固体という状態の中で異なる形態を持つことがあり(多形)、
この形態の違いを区別するために ”相” という概念が用いられます。
例えば、水は
- 水蒸気(気体)
- 水(液体)
- 氷(固体)
に状態が変化します。
しかし、固体には氷以外にも「雪」「雹(ひょう)」「霜(しも)」
といった別の形態も持っています。
これらを状態の変化ではなく、”相の転移” と捉えるのです。
SiO₂ の相転移
石英以外の SiO₂ の多形は、
非常に高温そして超高圧の環境下における相転移によって形成されます。
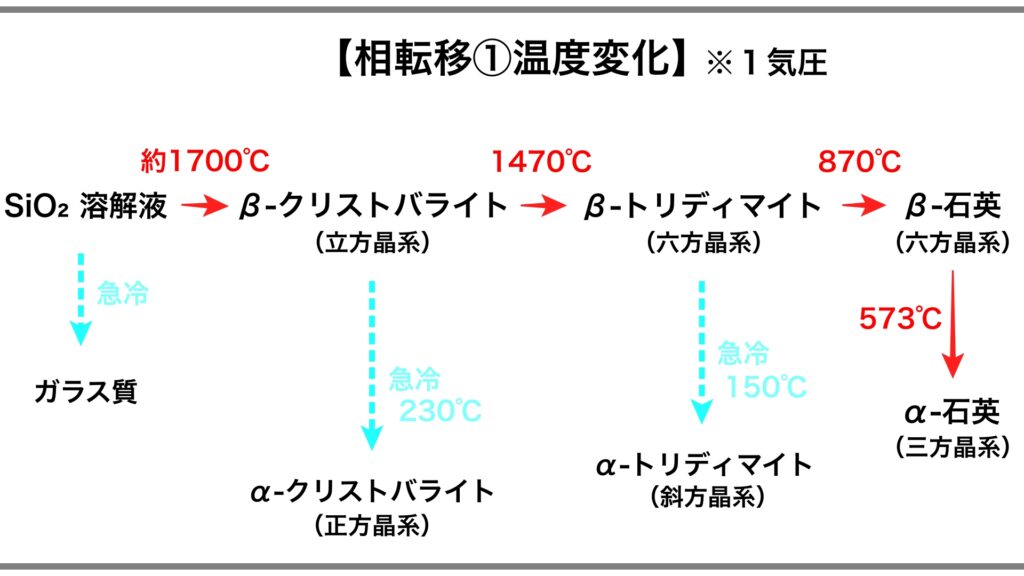
環境温度によって最も安定した結晶構造を取るため、それぞれ異なる相になります。
SiO₂ 溶解液を冷却すると、クリストバライト、トリディマイト、
そして石英へと相が転移するのが理論上の相転移です。
しかし実際には、
クリストバライトやトリディマイトは、火山活動によって形成されることが多く、
その場合、高温相のβ-クリストバライト、あるいはβ-トリディマイトとして形成されます。
のちに自然冷却によって、低温相のα-クリストバライト、α-トリディマイトに転移しますが、
その後は、そのままの状態で存在しているケースが一般的です。
この状態を「準安定状態」(じゅんあんていじょうたい)といいます。

理論的にはより安定な石英に相転移する可能性があるにもかかわらず、
現状を維持している状態を指します。

シリカ(SiO₂)は、通常の気圧(1気圧)から3万気圧くらいまでは、
前述のように温度変化に応じた相(鉱物)に転移しますが、
非常に高圧の環境では、また異なる相に転移します。

これらスティショバイト、コーサイトのことを
シリカの ”高圧相(こうあつそう)” と呼んでいます。
高圧相への転移は、圧力が決定的な条件となるので、
理論上は低温でもコーサイトやスティショバイトになり得ますが、
効率的に相転移するための適正温度というものがあって、
それは、ある程度高温になります。
また、自然界においてそのような超高圧の環境というのは、
地球の内部(地殻深くからマントル内)か、隕石の衝突などの特殊な条件下であり、
そのような場合、必然的に高温をともなっています。

前述したように、α-石英とβ-石英間では可逆性が認められますが、
それ以外の多形間の相転移は、限定的か非可逆的だと考えられています。

つまり、いちど形成された高圧相は、通常の大気圧下に置かれたとしても、
”準安定状態” のまま、石英になることはないようです。
終わりに
SiO₂ に関連する鉱物を ”結晶系” の違いでいくつか紹介しましたが、
自然界で目にするものは、β石英(低温型石英)がほとんどです。
一般的に ”石英” といえば、このβ石英のことを指しています。
しかし、この石英には種類や形態がたくさんあります。
それらは ”多形” ではなく、あくまで石英のバリエーションという位置づけです。

この石英グループに属する鉱物については、
こちらで詳しく解説しています。

